Иммунотерапия рака: нобелевская премия по медицине-2018
В медицине наблюдается серьёзный прорыв в лечении рака. В последние несколько лет были опубликованы результаты клинических исследований. Все они завершились полноценной победой над злокачественными новообразованиями.
Каждый год в России рак диагностируется у 600 000 человек. Причём 50% из них от болезни погибают. В первый год после обнаружения патологии летальный исход случается у 22% людей. Во всем мире этот показатель гораздо ниже.
О раке известно многое, но в то же время известно очень мало. Этот парадокс приводит к тому, что люди продолжают умирать от болезни. Особую проблему представляют запущенные формы онкологии, при которых опухоли дают метастазы. Справиться с такой патологией сложно. Наиболее благоприятный прогноз для тех пациентов, у которых рак диагностируется на ранних стадиях развития. Тем не менее, прорыв в лечении некоторых видов онкологии достигнут существенный.
Содержание:
- Общие сведения: что такое рак?
- Нобелевская премия по медицине 2018: в чём суть открытия
- Принцип действия метода
- Какие препараты используют для иммунотерапии рака
- Оценка рисков метода
- Метод генной иммунотерапии рака CAR-T
- В чём суть такого лечения?
- Схема проведения CAR T-клеточной терапии
- Зарегистрированные препараты для CAR-T
- Побочное действие CAR T-терапии
- Какие успехи были в генной иммунотерапии рака CAR-T?
- Над чем ещё работают учёные
Общие сведения: что такое рак?
Рак – это злокачественная опухоль, которая содержит мутированные клетки. Они быстро делятся и растут, поражая расположенные рядом ткани. В определённый период опухоль начинает распространять свои метастазы по всему организму.
Развиваться опухолевые новообразования могут из различных клеток человеческого организма: из дермы, костей, мышц, нервных волокон. Поэтому растут новообразования на различных участках тела. Чем больше врачи знают о месте локализации опухоли и строении её клеток, тем выше шансы на успешное избавление от новообразования. Специалисты имеют возможность составить оптимальную схему лечения. Несмотря на это, оставалось загадкой, почему одни опухоли вызывают быструю гибель больного, другие хорошо поддаются терапии, а третьи появляются снова через несколько лет.
Раковая опухоль не контролируется организмом. Её клетки имеют собственное ДНК. Они умеют маскироваться таким образом, что иммунитет не видит их.
Методы лечения раковых опухолей, которые применяются на практике:
Операция. Она призвана удалить первичный очаг опухоли и метастазов, избавить человека от осложнений, который были вызваны растущим новообразованием.
Химиотерапия. Лечение направлено на уменьшение опухоли в размерах, на удаление метастазов. С её помощью удаётся снизить риск рецидива патологии.
Лучевая терапия. Этот лечебный метод оказывает влияние на опухоль, на местном уровне, что позволяет подавить рост новообразования.
Гормональная терапия. Её показано пройти пациентам, которые страдают от рака молочной железы или простаты.
Главным недостатком химиотерапии и лучевой терапии является то, что в ходе лечения страдают не только атипичные, но и здоровые клетки. Поражению подвергается кожа, слизистые оболочки и костный мозг. Именно в последнем органе формируются клетки крови. Поэтому у пациентов, проходящих химиотерапию, развивается масса побочных эффектов. У них диагностируют анемию, они начинают страдать от проблем с кишечником, у них выпадают волосы. Даже при условии использования самых современных препаратов и методик, врачи не имеют возможности защитить здоровые клетки организма.
Нобелевская премия по медицине 2018: в чём суть открытия
В Стокгольме 1 октября 2018 года была вручена Нобелевская премия по медицине и физиологии. Получили её сразу 2 учёных – это американец Джеймс Эллисон и японец Тасуку Хондзё. Награда была вручена за выполненные ими исследования в области лечения раковых опухолей.

Иммунолог Джеймс Эллисон (James P. Allison), профессор Онкологического центра и. Монро Андерсона Техасского университета, член Национальной академии наук США и Национальной медицинской академии США. Учёному сейчас 70 лет.

Иммунолог Тасуку Хондзё (Tasuku Honjo). Он является профессором Киотского университета, в котором преподает с 1984 года. Ученый является членом Национальной академии наук США, Германской академии естествоиспытателей «Леопольдина» и Японской академии наук.
Заслуга учёных состоит в разработке инновационного подхода к лечению рака. Их метод отличается от используемой во всём мире химиотерапии и лучевой терапии. Название метода – Immune checkpoint therapy. Это иммунотерапия рака, которая позволяет уменьшить активность атипичных клеток и не допустить разрушения иммунной системы. Применение этого метода заставляет иммунную систему активно атаковать клетки новообразования [1].
Учёным удалось обнаружить способность организма к подавлению активности Т-лимфоцитов. Эти иммунные клетки отвечают за уничтожение раковых опухолей. Если заблокировать механизмы подавления Т-киллеров, то лимфоциты «высвобождаются» и начинают самостоятельно ликвидировать опухолевые новообразования.
Принцип действия метода
Иммунная система человека состоит из множества клеток. Если рассматривать её глобально, то защита организма представлена активаторами (стимуляторами) и ингибиторами (процесс торможения). Когда эти две системы уравновешивают работу друг друга, здоровье у человека отличное. Иммунитет в состоянии справиться с любой болезнью самостоятельно.
Т-лимфоциты – это белые кровяные тельца, которые представлены супрессорами, киллерами и хелперами. Каждый тип клеток отвечает за определённую функцию. Т-хелперы должны распознать свои и чужеродные клетки. При обнаружении атипичных клеток они стимулируют иммунную систему к усиленной работе. К проблемному месту начинают прибывать Т-киллеры и фагоциты, параллельно активизируется процесс выработки антител.
Т-киллеры являются самыми значимыми клеткам, обеспечивающими защиту организма. Учёные называют их клетками-убийцами или цитотоксическими лимфоцитами («цито» - клетка, «токсические» - ядовитые»). Они реагируют на все чужеродные или неполноценные клетки и белки в организме. Раковые опухоли представлены именно такими клетками.
За подавление иммунных процессов в организме отвечают Т-супрессоры. Они не дают иммунитету проявлять чрезмерную активность. Это позволяет избежать развития аутоиммунных заболеваний.
Когда в организме начинает расти опухоль, в ней образуются белки, которые имеют атипичное строение. Они отличаются от тех белков, к которым организм привык. Т-клетки реагируют на них как на чужеродные объекты.
Опухоль, в стремлении сохранить собственную жизнеспособность, пытается обмануть иммунитет. Раковые клетки обладают умением маскироваться. Они убирают со своей поверхности дефектные белки, либо уничтожают их. Опухоли даже способны продуцировать специальные вещества, которые снижают активность иммунной системы человека. Чем активнее новообразование, тем меньше у иммунитета остаётся шансов, чтобы с ним справиться.
Открытие Джеймса Эллисона. Этот учёный нашёл способ разблокировки иммунной системы с помощью антител, позволяющих избавиться от белка-тормоза. Врач изучал функции клеточного белка Т-лимфоцитов (ему дано название CТLA-4). Ему удалось установить, что именно он блокирует работу Т-киллеров. Ученый пытался найти способ разблокировки иммунитета. В процессе проводимых исследований доктор решил создать антитело, которое сможет связать белок-тормоз и будет препятствовать его работе.
Эксперименты проводились над грызунами, больными раком. Ученый пытался выяснить, поможет ли блокировка CTLA-4 активизировать иммунитет и заставить его работать против опухолевого новообразования [2].
Главной заслугой Эллисона является то, что он первым выдвинул версию относительно «нездорового» появления CTLA-4 на Т-киллерах. То есть этот белок образуется на иммунных клетках для того, чтобы опухоль могла их остановить. Каждая активная Т-киллер клетка имеет ингибирующую молекулу, конкурирующую с другими молекулами за приём сигнала от иммунной системы (сигналы могут быть двух видов: включения и выключения защитных сил организма). Если на поверхности Т-киллера располагается CTLA-4, то она перехватывает поступающие от Т-хелперов сигналы и иммунитет не направляет усилия на борьбу с раковыми опухолями.
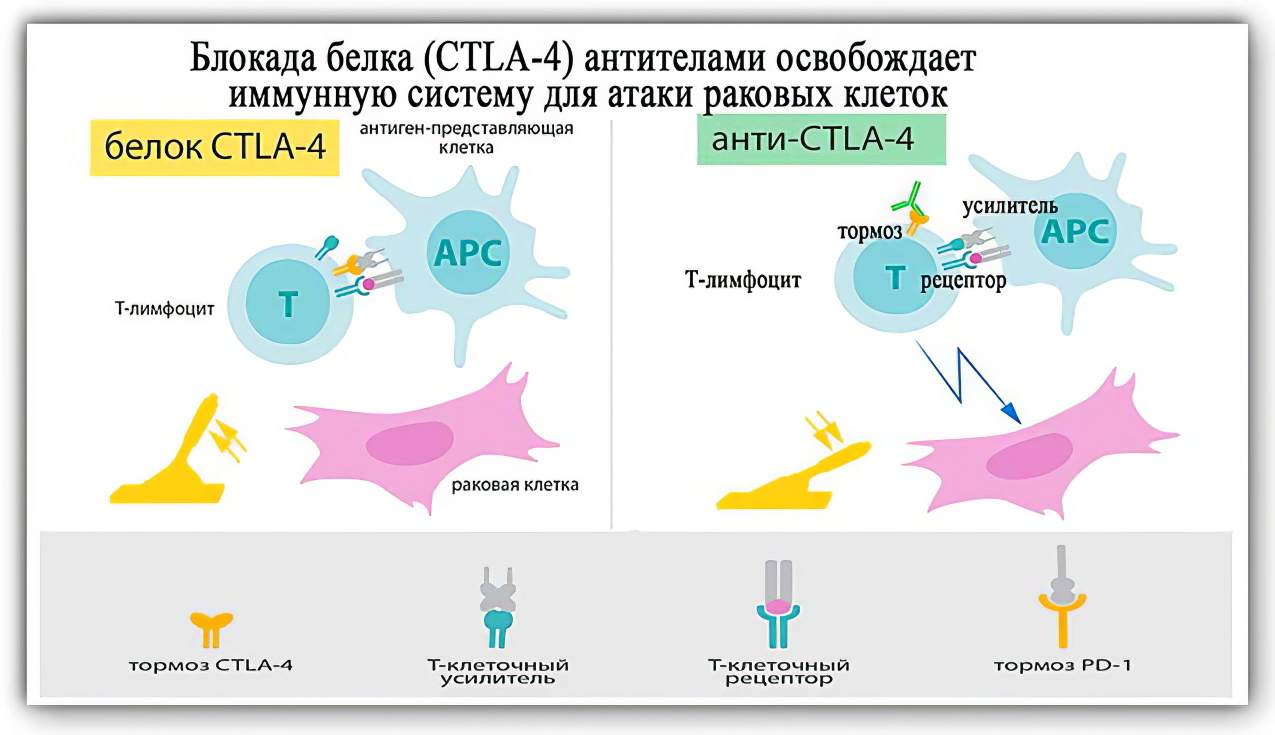
В 2010 году учёный провёл испытания уже не с грызунами, а с людьми, страдающими раком кожи (меланомой). У части его пациентов после проведённой иммунотерапии полностью исчезли остаточные следы этого агрессивного вида рака.
Открытие доктора Тасуку Хондзё. В 1992 году этот японский учёный выявил на поверхности Т-лимфоцитов молекулы белка PD-1. Расшифровывается эта аббревиатура как Programm cell death protein 1, что в переводе с английского языка означает «белок запрограммированной смерти клеток». Ученый установил, что он работает как тормоз.Белок не только сдерживает рост новообразования, но и блокирует Т-киллеры [3].
Тасуку Хондзе синтезировал антитела к PD-1, которые позволили устранить имеющуюся блокировку и повысить активность иммунной системы в отношении раковых клеток.
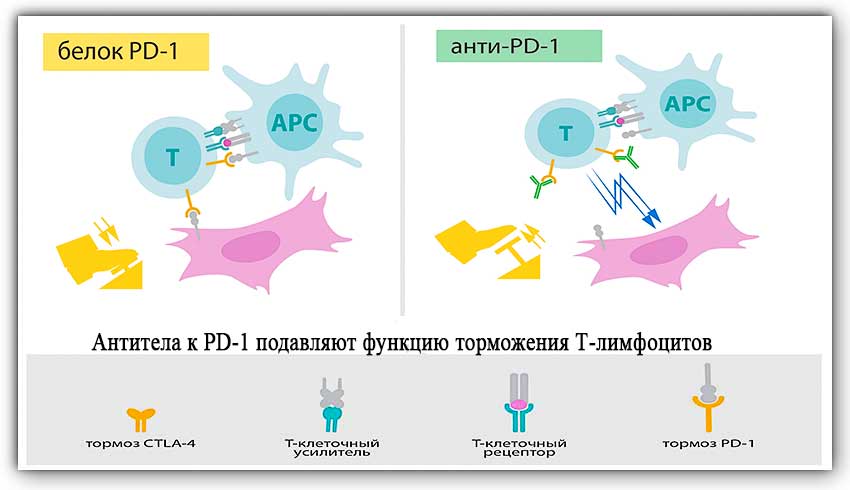
Антитела против PD-1 эффективны в отношении лечения меланомы, немелкоклеточного рака лёгких, почечной карциномы, лимфомы Ходжкина и не только.
PD-1 и CTLA-4 и их сигнальные пути учёные назвали иммунными чекпоинтами. Им удалось показать, как с помощью уничтожения элементов, сдерживающих иммунную систему, можно справиться с раковыми опухолями.
С момента открытия прошло уже более 15 лет. За это время были разработаны и внедрены в практику препараты, которые содержат ингибиторы иммунных чекпоинтов. В лечении рака используют 1 препарат, блокирующий CTLA-4 и пять препаратов, блокирующих PD-1. Такая разница в количестве созданных средств объясняется тем, что многие опухоли на своей поверхности также имеют PD-1. Поэтому препараты-блокаторы PD-1 позволяют прицельно воздействовать на опухоль, а блокаторы CTLA-4, влияют только на активность Т-киллеров. Кроме того, осложнений от использования блокаторов PD-1 возникает меньше.
Какие препараты используют для иммунотерапии рака?
Первое клиническое испытание препаратов было проведено в 2006 году на людях, больных раком. В нём участвовало средство под названиеь Ниволумб. Этот препарат является блокатором PD-1. Однако одобрен для лечения онкологических пациентов он был только в 2014 году. В это же время завершились все испытания препарата Пембролизумаб, выпуском которого занимается компания Merсk.
В России прошли регистрацию такие препараты, как:
Пембролизумаб (Кейтруда). Его применяют для лечения рака лёгких и меланомы [4]. Его несомненным достоинством является высокая эффективность в терапии метастатических злокачественных опухолей. Цена одного флакона составляет 3290 евро.
Опдиво (Ниволумаб). Этот препарат является аналогом Кейтруды, но стоит он меньше. Его с успехом применяют для лечения рака почек и меланомы. Стоимость лекарственного средства 915$ за упаковку в 40 мг и 2200$ за упаковку в 100 мг. В зависимости от поставщика и производителя препарата цена на него может отличаться.
Ервой (Ипилимумаб). Лекарственное средство назначают взрослым и детям старше 12 лет в дозировке 3 мг/кг. На полноценный лечебный курс потребуется 4 дозы. Вводят его в течение 1 часа 30 минут. Процедуру проводят 1 раз в 21 день. Стоимость одного флакона дозировкой 50 мг/10 мл: 4200-4500 евро, а дозировкой 200 мг/40 мл – 15 000 евро.
Тецентрик (атезолизумаб). Это лекарственное средство назначают для лечения уротелиального и немелкоклеточного рака лёгких. Цена на препарат зависит от посредников и места покупки. В США 1 флакон стоит 6500-8000$.
Эти препараты используют как самостоятельные единицы, так и в различных комбинациях. Такое лечение показано пациентам с неоперабельной меланомой, давшей метастазы, с лимфомой Ходжкина, с рецидивирующим и метастатическим плоскоклеточным раком шеи и головы, а также при неоперабельном раке мочевого пузыря.
В России тоже выпускаются иммунологические препараты для лечения раковых опухолей. Нужно понимать, что практическое применение чек-пойнт терапии только началось. Естественно, что через несколько лет препаратов данной группы станет гораздо больше. С их помощью можно будет лечить другие виды рака. Стоимость терапии будет доступнее, так как большая часть расходов осталась позади.
Оценка рисков метода
Иммунотерапию не следует воспринимать как панацею от рака. Использование этих препаратов не позволяет гарантировать 100% выздоровления больного. Действуют лекарственные средства не на все виды раковых опухолей. Значение имеет генотип конкретного больного.
Лечение иммунологическими препаратами сопряжено с риском возникновения побочных эффектов. Главным образом они сводятся к развитию аутоиммунных реакций. Так как основные действующие вещества оказывают влияние на иммунитет человека, активизируя его, он начинает работать слишком активно. Поэтому у больного часто возникают аутоиммунные воспаления внутренних органов.
Ещё одним недостатком таких препаратов является то, что их можно использовать для лечения взрослых людей. Маленьким пациентам их не назначают.
Запрещено назначать иммунологические препараты беременным женщинам, так как это приведёт к гибели плода. Дело в том, что ребёнок, находящийся внутри утробы матери, использует те же механизмы ухода от иммунитета, что и раковые опухоли.
У некоторых больных эти лекарственные средства не действует вовсе, так как клетки опухоли проявляют особенную манёвренность и скрываются от атак усиленной иммунной системы.
Метод генной иммунотерапии рака CAR-T
CAT-T – это инновационный метод лечения раковых опухолей, который был представлен Американским обществом клинической онкологии (ASCO) в докладе «Успехи клинической онкологии 2018» [5].
Терапия основывается на возможностях Т-лимфоцитов бороться с химерными антигенными рецепторами. Сокращённо такой метод лечения называют CAR-T (chimeric antigen receptor T-cell).
Над тем, чтобы создать химерные антигенные рецепторы CAR впервые задумался Зелиг Эшхар из Института наук имени Вейцмана, который находится в израильском Реховоте. Химик и иммунолог по образованию, он впервые получил трансгенные Т-лимфоциты, содержащие CAR. Открытие было сделано в его лаборатории.
Однако клинические исследования этой новой методики лечения рака были завершены лишь к 2017 году. В ходе их проведения были созданы и разрешены к использованию 2 лекарственных средства Kymriah и Yescarta.
Если рассматривать CAR-Т глобально, то его можно отнести сразу к нескольким методикам лечения: к генной, клеточной и иммунотерапии.
В чём суть такого лечения?
CAR-технология позволяет задать иммунным клеткам больного новую программу вне его тела. Учёные создают CAR Т-клетки, которые обладают способностью находить раковые опухоли и уничтожать их. Полученные клетки CAR используют для адОптивной иммунотерапии (адОптивной - одна из разновидностей в лечении рака).

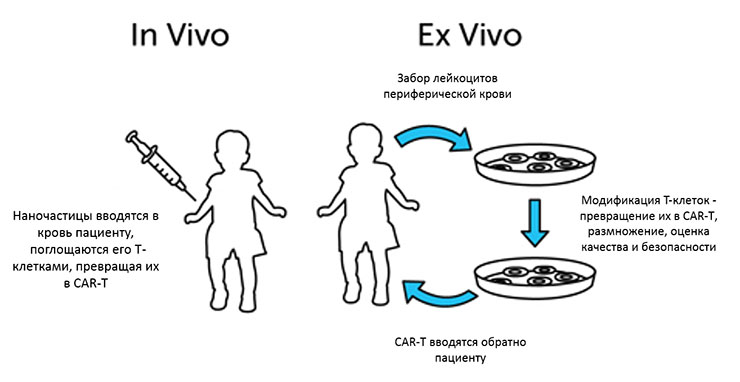
Получают CAR T-клетки благодаря технологии ex vivo, то есть из крови человека. Из неё выделяют Т-лимфоциты, которые отвечают за защиту организма от раковых и других патологических клеток. Затем в хромосому Т-клетки встраивается ДНК, кодирующая CAR. Благодаря таким изменениям, Т-лимфоциты начинают вырабатывать на своей поверхности химерные рецепторы. Они позволяют Т-клеткам находить маркеры, располагающиеся на поверхности раковых опухолей. После их обнаружения иммунной системе посылается сигнал к атаке. Размножают CAR T-клетки вне организма человека, после чего их вводят в кровь больного.
Если генноизменённая клетка встречается с нормальной здоровой клеткой, то на неё она реакции не даёт. При обнаружении раковой клетки химерный антигенный рецептор «видит» на ней маркер, на который он был заранее запрограммирован. Т-лимфоцит набрасывает на опухолевую клетку и уничтожает её, после чего начинает активно делиться. Это позволяет полностью избавиться от рака.
Т-лимфоциты, которые вводятся в организм больного, обладают способностью к увеличению своей численности. Поэтому учёные относят полученный препарат к «живым». Изначально в кровь поступает лишь несколько изменённых Т-клеток. При обнаружении раковой опухоли эти клетки активно делятся, превращаясь в целую армию.
До тех пор, пока все клетки опухоли не будут уничтожены, CАR-лимфоциты не закончат работать. Когда раковых клеток в организме не останется, большинство из них погибнет. Однако небольшой запас всё-таки сохранится в костном мозге. Если случится рецидив болезни, то они снова начнут делиться для противостояния раку.
Этот метод подходит для лечения таких видов опухолей, как:
Агрессивная В-клеточная лимфома.
Острая лимфобластная лейкемия у детей и взрослых.
В-клеточная крупноклеточная лимфома. Есть возможность с помощью такого метода избавиться от диффузной лимфомы.
Сейчас учёные ведут исследования, направленные на борьбу с другими видами опухолями методом CAR.
Схема проведения CAR T-клеточной терапии
CART относится к инновационным методам лечения рака, который был разработан в Америке. Уже сейчас ведущие онкологические клиники мира отработали эту схему лечения. Её реализация на практике считается безопасной и надёжной.
Рисунок - методы клеточной терапии ex vivo и in vivo:
Для начала пациенту нужно будет пройти ряд диагностических процедур. Если противопоказания к CART отсутствуют, то больному назначают лечение. Длится оно несколько недель. В этот период человек будет находиться то в стационаре, то дома.
1.Первый этап: забор крови. Врачи с помощью специальной аппаратуры осуществляют забор крови больного. Её разделяют, вычленяя лейкоциты. Эта процедура носит название лейкаферез. Сдача крови занимает около 5 часов.
2.Второй этап: обработка Т-лимфоцитов. Генетическую модификацию клетки крови претерпевают в условиях лаборатории. Учёные индуцируют экспрессию химерных антигенных рецепторов, которые будут искать и ликвидировать опухолевые клетки. В это время человек может находиться вне больничных стен.
3.Третий этап: проведение химиотерапии пред реализацией CART. Перед тем как ввести обработанные Т-лимфоциты, человеку потребуется повторно сдать анализы. Иногда случается так, что дальнейшее лечение этим методом уже невозможно. Если ничего не изменилось, то больному назначают химиотерапию на непродолжительный срок. В этот период анализы нужно будет сдавать каждый день.
4.Четвёртый этап: введение Т-лимфоцитов. Их инфузия занимает около получаса, хотя иногда процедура может занять до 1 часа 30 минут. Затем ещё около 5-6 часов человек должен оставаться под врачебным контролем. Если имеется риск развития побочных эффектов, то пациента оставляют в больнице на несколько дней.
FDA требует, чтобы наблюдение за больными, прошедшими CART, продолжалось не менее 15 лет.
Зарегистрированные препараты для CAR-T

В 2017 году были утверждены 2 препарата, которые подходят для проведения CART. Их приняло Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) на основании проведённых клинических испытаний.
Kymriah (тизагенлеклейкел / tisagenlecleucel). Это первое лекарственное средство, которое выпускается компанией Novartis. Его начали массово применять с 30.08.2017. Лечение может быть проведено у детей и у взрослых людей младше 25 лет с диагнозом рак крови на последних стадиях [6].
Kymriah назначают больным, у которых не удалось добиться положительной динамики в лечении рака крови консервативными методами и с помощью пересадки костного мозга. Рецидив патологии не является противопоказанием к проведению терапии.
Не позволяет внедрить препарат Kymriah для массового использования его высокая стоимость. Чтобы создать генные Т-клетки и ввести их пациенту, потребуется 475 000 $. Стоимость указана без учёта оплаты услуг госпиталя.
Хотя лекарственное средство уже доступно к применению, учёные продолжают заниматься изучением его свойств. Сейчас препарат находится на стадии постмаркетинговых наблюдательных исследований.
Yescarta (аксикабтагн цилолейкел / axicabtagene ciloeucel). Это второй препарат, который можно использовать для реализации CAR T-клеточной терапии. Его начали использовать с 18.10.2017 года. Выпускается он компанией Kite Pharma Inc.
Лечение этим препаратом проводят пациентам с В-клеточной крупноклеточной лимфомой у взрослых людей, при условии, что болезнь не реагирует на другие виды терапии и рецидивирует. Единственным противопоказанием является первичное поражение лимфомой головного или спинного мозга [7].
Цена на этот препарат крайне высока и составляет 373 000 $. Производители лекарственного средства активно ищут способы, позволяющие удешевить процесс его создания. Это позволит сделать препарат доступным для большего количества людей.
Побочное действие CAR T-терапии
Реализация метода CAR T-терапии позволяет клеткам иммунной системы обнаружить опухоль и уничтожить её. Однако активизация иммунитета не может пройти бесследно для организма. Часто у больных развиваются тяжёлые побочные эффекты.
Для того чтобы иметь возможность проводить CAR T-терапию, медицинские учреждения должны иметь специальный сертификат. Врачи обязаны осведомить больного о том, какие последствия для здоровья возникают после проведённого лечения. Важно оценить все возможные риски.
Развиваются побочные эффекты на 1-22 день после введения изменённых клеток.
К ним относятся:
Ослабление иммунной системы, резкое снижение уровня лейкоцитов в крови, развитие инфекций.
Острая почечная недостаточность. Это осложнение встречается нечасто.
Нарушения со стороны нервной системы. Иногда может развиться отёк головного мозга.
Самой частой побочной реакцией является так называемый цитокиновый шторм. Он развивается у 75% пациентов. Цитокины – это белки, которые контролируют работу иммунитета. После встречи изменённых Т-клеток с опухолью в кровь выбрасывается огромное количество цитокинов. Сопровождается такая реакция повышением температуры тела, рвотой, диареей, усилением слабости. Если справиться с этим состоянием не получается в течение долгого времени, повышается вероятность летального исхода.
Чтобы не допустить массового выброса цитокинов в кровь рекомендуется применение средств-блокаторов.
Для того чтобы препятствовать развитию цитокинового шторма пациенту назначают препарат Актемра (Tocilizumab) или классические НПВС, например, Диклофенак.
Какие успехи были в генной иммунотерапии рака CAR-T?

30 ноября были подведены итоги годовой реализации генной терапии на практике. Заказчиком выступило Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США. Именно эта организация дала разрешение на использование лекарственных средств. Итоги были опубликованы в журнале New England Journal of Medicine. Лечение прошли 93 пациента [8].
Установлено, что 37 пациентам удалось полностью избавиться от болезни. Ещё 11 человек начали чувствовать себя гораздо лучше, но полной победы над раком достичь не удалось. Поэтому учёные сделали выводы, что работает методика на 50%.
Ситуация в России
В России впервые технология CART была реализована в Центре детской гематологии им. Дмитрия Рогачева (НМИЦ ДГОИ). Руководителем многолетних работ является доктор медицинских наук Михаил Масчан. На начальном этапе проект поддерживал фонд «Подари жизнь». Возможность реализации метода в стенах указанного лечебного учреждения появилась благодаря пожертвованиям топ-менеджмента компании Роснефть и фонду «Врачи, инновации, наука – детям».
В 2018 году лечение получили 20 детей и молодых людей с острым лимфобластным лейкозом и В-клеточными лимфомами. Другие терапевтические методы не позволили добиться выздоровления. Оставалась единственная надежда на CART.
В России каждый год такое лечение требуется нескольким десяткам детей и нескольким сотням взрослых. Михаил Масчан.
Над чем ещё работают учёные

В 2018 году были достигнуты колоссальные успехи в плане лечения раковых заболеваний. В 2019 году ожидаются новые прорывы.
Иммунотерапия рака
Кроме описанной CFR T-клеточной терапии на стадии разработки находится терапия опухоль-инфильтрирующими лимфоцитами (TIL). Этот метод уже позволил избавиться от метастатического рака молочной железы 49-летней пациентке. Однако крупных клинических испытаний ещё проведено не было [9].
Жидкая биопсия: точный и простой анализ на рак
Жидкая биопсия позволит диагностировать рак по анализу крови. Новые тесты дают возможность контролировать процесс лечения и предвидеть возможный рецидив.
В последнее время появилось множество тестов от различных компаний, которые заверяют в эффективности их продукции. Однако в 2018 году Американское общество клинической онкологии (ASCO) заявило, что большинство такой продукции нельзя применять для выявления и мониторинга болезни. Это объясняется отсутствием доказанной эффективности этих тестов [10].
Снижение побочных эффектов лечения
Если в прошлые десятилетия основные усилия прилагались к тому, чтобы найти эффективные способы борьбы с раком, то в 2018 году были проведены исследования, направленные на снижение побочных эффектов от проводимого лечения. В первую очередь это касается мужского бесплодия и нарушения полового созревания у девочек после проведённой химиотерапии. Достаточно внимания было уделено недопущению косметических дефектов внешности, которые возникают после удаления молочной железы и пр.
Онкозаболевания и микрофлора организма
Появились научные статьи, которые указывают на то, что микрофлора способна предугадать реакцию организма на химиотерапию [11].
Публикация в журнале Nature Communications [12] указывает на то, что определённые бактерии, присутствующие в микробиоме человека способны влиять на состояние его иммунной системы и вызывать рост множественной меланомы (рак крови, который не поддаётся лечению). Не исключено, что уничтожение обнаруженных бактерий позволит оказать влияние на лечение рака.
Органоиды
Органоиды – это миниатюрные органы, искусственно выращенные в лаборатории из собственных клеток человека, которые могут трансформировать онкологию. Информация об этом появилась в СМИ ещё в 2017 году. На органоидах можно проводить пробы различных препаратов и предвидеть, какую реакцию даст на лечение организм пациента.
Эти технологии были взяты на вооружение многими крупными организациями. Органоиды поставляют в различные лаборатории, благодаря чему уже удалось повысить эффективность проводимых работ по скринингу противоопухолевых лекарственных средств.
Органоиды не являются идеальной средой для тестирования лекарственных средств. Эти мини-органы не снабжаются кровью и не имеют связи с другими системами организма. Однако учёные продолжают совершенствовать органоиды и способы их выращивания. В будущем они будут использоваться гораздо активнее.
Видео: профессор Daniel Chen (США) на конференции «Иммуноонкология» (6 апреля 2018 г., Москва) «Иммунотерапия рака: от теоретических основ к прорывам в лечении»: